Проведение инспекцийклинических испытаний лекарственныхсредств в Украине - кем проводятся инспекции, их основные задачи, инспекционные группы, как проводится инспекция
Статьи
В Украине инспекции клинических испытаний проводятся Государственным фармакологическим центром МЗ Украины, а именно отделом аттестации и инспекции клинических баз (далее - отдел инспекции), являющимся его структурным подразделением. Сотрудники отдела, созданного в 1999 г., имеют опыт работы в области организации и проведения клинических испытаний лекарственных средств, а также не зависят от субъектов испытания и не принимают непосредственного участия в проведении клинических испытаний [4].
Инспекционной проверке подлежат все клинические испытания лекарственных средств, включая многоцентровые испытания, которые проводятся в Украине после их официального разрешения Государственным фармакологическим центром МЗ Украины (далее - Центр).
В своей деятельности отдел инспекции руководствуется нормативными документами [4, 5], разработанными на основании Закона Украины «О лекарственных средствах» (1996), а также Стандартными операционными процедурами «Проведение инспекционной проверки клинического испытания в Украине» [6].
Основными задачами инспекций клинических испытаний является проверка:
• соответствия проведения клинических испытаний утвержденному протоколу и действующим нормативным требованиям;
• возможности проведения клинических испытаний на данной клинической базе: включение достаточного количества испытуемых в соответствии с протоколом; проверка оборудования, лаборатории, наличия первичной документации - историй болезней, амбулаторных карт, данных лабораторных и инструментальных методов исследования;
• ознакомленности исследователей и персонала, принимающих участие в клинических испытаниях, с протоколом и другой информацией, касающейся исследуемого препарата;
• защиты прав пациентов: наличие письменного информированного согласия на участие в клиническом испытании;
• соответствия и достоверности записей в индивидуальных регистрационных формах (ИРФ) данным первичной документации;
• документации о получении, хранении, выдаче, распределении и возврате исследуемого лекарственного препарата;
• своевременного предоставления информации о побочных реакциях.
Инспекционная проверка может проводиться в плановом порядке - в ходе клинических испытаний, ретроспективно - по данным архива и целенаправленно - при рассмотрении отдельных вопросов, а именно:
• при возникновении серьезных или непредвиденных побочных эффектов;
• для проверки выполнения рекомендаций, сделанных в ходе предшествующих проверок;
• при одновременном проведении клинических испытаний более 2 препаратов на одной клинической базе;
• при включении в исследования особого контингента: беременных и женщин в период лактации, здоровых добровольцев, ВИЧ-инфицированных, пациентов с психическими расстройствами.
В зависимости от вида проверки в состав инспекционной группы могут включаться эксперты, специализирующиеся в различных отраслях медицины.
Процедура проведения плановой инспекции включает следующие этапы: подготовка, непосредственно проведение проверки на клинической базе, обсуждение результатов, оформление отчета и акта по результатам проверки (рис. 1).
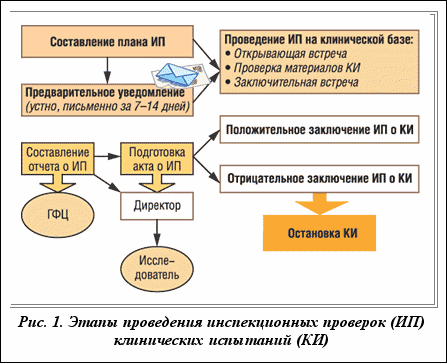
О предстоящей инспекционной проверке руководитель клинического испытания уведомляется в письменной и устной форме за 7-14 дней до ее проведения. В уведомлении указывается:
• цель, дата, время, место, где будет проводиться инспекционная проверка;
• перечень документов, необходимых для проведения проверки;
• перечень помещений, оборудования и лабораторий, которые задействованы в исследовании [7].
Перед началом проведения инспекции составляется план, где определены цель и объем проверки клинических испытаний. План проверки устанавливает лишь минимальный объем, который может быть расширен на основании материалов, полученных в результате инспекции.
Инспектор выполняет работу в строгом соответствии с планом проверки и установленными требованиями (стандартными операционными процедурами).
Лица, проводящие инспекцию и имеющие право прямого доступа к первичной документации, должны принимать разумные меры предосторожности для соблюдения анонимности испытуемых и конфиденциальности информации.
Непосредственно во время инспекционной проверки проверяются:
• комплектация файла исследователя;
• документация по получению, учету и распределению исследуемого лекарственного средства;
• условия хранения исследуемого лекарственного средства;
• документация о возврате или уничтожении (если предусмотрено) неиспользованного лекарственного средства после завершения клинического испытания;
• соответствие данных индивидуальных регистрационных форм данным первичной документации (историям болезней, амбулаторным картам);
• работа лаборатории отделения (кабинетов) функциональной диагностики;
• состав и деятельность комиссии по вопросам этики, действующей при клинической базе.
Обычно осмотр лабораторий осуществляется как часть проверки места проведения клинических испытаний; кроме лаборатории, инспектор может посетить и аптеку, если она включается в процедуру «движения» исследуемого лекарственного средства; документацию по транспортировке или утилизации препарата.
Во время инспекции заполняются проверочные листы, которые по завершении проверки подписывают инспекторы и руководитель клинического испытания. Инспекционная проверка завершается встречей с исследователями, на которой обсуждаются выявленные нарушения и выносятся рекомендации по их устранению.
После окончания инспекционной проверки составляются отчет и акт, которые подписывает руководитель Центра. Акт, в котором указываются результаты проверки и срок, необходимый для устранения выявленных замечаний, отправляется руководителю клинического испытания и заказчику (спонсору). Результаты инспекционных проверок докладываются и обсуждаются на заседаниях Научно-экспертного совета Центра.
В тех случаях, когда в процессе проведения клинических испытаний выявляются серьезные нарушения, клинического испытания могут быть остановлены. К таким случаям относятся:
• угроза жизни или здоровью испытуемых;
• нарушение этических норм проведения испытания;
• выявление серьезных побочных эффектов, отсутствие или недостаточная эффективность лекарственных средств.
Если такие нарушения выявляются при проведении инспекционной проверки, то в Центр предоставляется подробный отчет о выявленных нарушениях. После рассмотрения отчета на заседании Научно-экспертного совета Центра принимается решение об остановке клинических испытаний или отдельного его этапа. Дальнейшее возобновление клинических испытаний возможно после устранения всех выявленных нарушений в установленном порядке.
Анализ инспекций клинических испытаний лекарственных средств в Украине
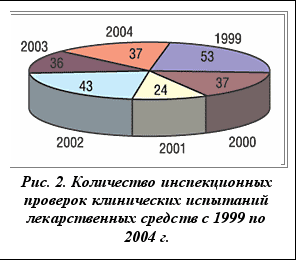
В Украине инспекции лекарственных средств проводятся с 1999 г. За этот период было проведено 230 инспекций клинических испытаний (рис. 2), среди них - 10 международных многоцентровых исследований (в 8 случаях проводилась инспекционная проверка клинических баз, в 2 - офиса заказчика). Основные замечания:
• неукомплектованный файл исследователя;
• нарушение маркировки исследуемого лекарственного средства;
• нарушение процедуры получения информированного согласия;
• замечания по ведению ИРФ;
• замечания по ведению первичной документации;
• несвоевременное предоставление информации о побочных реакциях.
 С 1999 по 2004 г. восемь клинических испытаний было приостановлено вследствие выявленных нарушений, связанных с несоблюдением условий протокола и нормативных требований проведения клинические испытания. После исправления недостатков и проведения повторных проверок клинические испытания были продолжены. За тот же период было остановлено два клинических испытания. Одно из них - в связи с развитием серьезных побочных реакций у большинства испытуемых, а другое - в связи с нарушением требования к маркировке исследуемого лекарственного средства.
С 1999 по 2004 г. восемь клинических испытаний было приостановлено вследствие выявленных нарушений, связанных с несоблюдением условий протокола и нормативных требований проведения клинические испытания. После исправления недостатков и проведения повторных проверок клинические испытания были продолжены. За тот же период было остановлено два клинических испытания. Одно из них - в связи с развитием серьезных побочных реакций у большинства испытуемых, а другое - в связи с нарушением требования к маркировке исследуемого лекарственного средства.
Избежать большинства выявленных недостатков можно было в случае проведения мониторинга клинического испытания со стороны заказчика (спонсора), поскольку гарантия качества испытания зависит не только от регуляторных органов, но и от взаимодействия спонсора и исследователей.
Центр ежегодно проводит семинары для исследователей по вопросам клинических испытаний. В программу семинаров включаются вопросы проведения инспекционных проверок, рассматриваются и обсуждаются выявленные во время инспекций недостатки и ошибки, а также оговариваются рекомендации по их предупреждению.
В Украине создана нормативная база для проведения инспекционных проверок клинических испытаний. Это важный и необходимый этап контроля за проведением испытаний лекарственных средств со стороны регуляторных органов для подтверждения эффективности и безопасности изучаемых лекарственных средств, которые впоследствии будут разрешены для медицинского применения, а также гарантия защиты прав испытуемых, участвующих в клинических испытаниях. Кроме того, это накладывает ответственность за качество испытаний и на заказчиков (спонсоров), которые со своей стороны должны контролировать их, проводя мониторинг и аудит. Для исследователей инспекция клинических испытаний - это не только контролирующий, но и обучающий процесс. Опыт, приобретенный в процессе проведения клинических испытаний и инспектирования, будет использоваться исследователями в других проектах.
Дмитриева Елена Германовна



